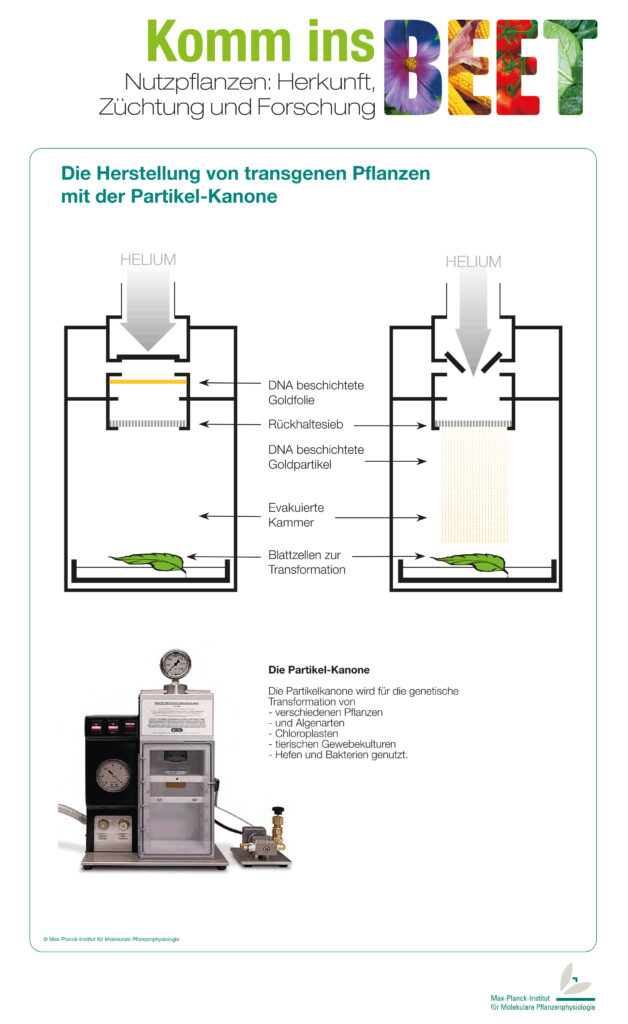
Um ein neues Gen in Pflanzen einzuschleusen, benutzen die Forscher oft das Bodenbakterium Agrobacterium tumefaciens. Eine andere Möglichkeit bietet die Genkanone, mit der man DNA-Stücke in Pflanzenzellen hineinschießen kann. Mit dieser Methode kann man auch die DNA von Chloroplasten verändern.
Wenn neue Gene stabil in die DNA von Pflanzen integriert werden, spricht man von einer Transformation. Das bedeutet, dass die Pflanzenzellen diese neue DNA, als Teil ihrer eigenen betrachten, ablesen und die entsprechenden Proteine herstellen.
Transformation mit Agrobakterien
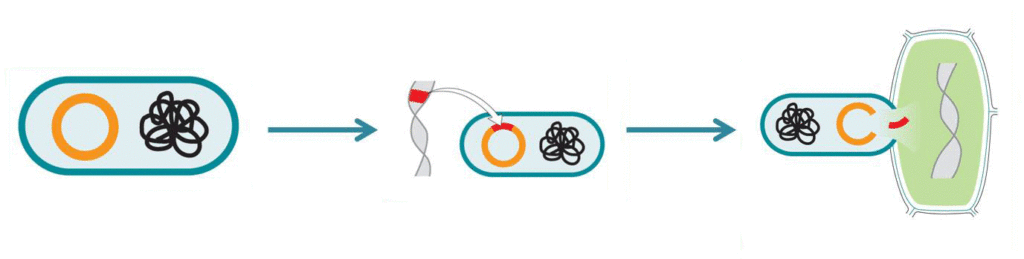
Wenn Agrobakterien verletzte Pflanzenzellen befallen, können sie Teile ihrer Erbinformation in die Pflanzenzelle einschleusen. Diese fangen dann an tumorartig zu wuchern und für das Bakterium wichtige Nährstoffe zu produzieren. Im Labor wurde Agrobacterium tumefaciens so verändert, dass es weder das Tumorwachstum auslöst noch die Pflanze zur Produktion von Bakteriennahrung anregt. Stattdessen können jetzt ganz gezielt neue Gene in die Pflanze eingebracht werden.
Dazu muss man zunächst wissen, dass Pflanzenzellen totipotent sind. Das bedeutet, dass aus einer einzigen Pflanzenzelle wieder eine ganze Pflanze heranwachsen kann. Diese ganz besondere Eigenschaft von Pflanzenzellen macht die Arbeit für die Forscher erheblich einfacher.

Agrobakterien enthalten zwei Arten von DNA, die im Bild als schwarzes Knäuel und oranger Ring dargestellt sind. Der orange Ring stellt die Plasmid-DNA dar. Hier sitzen die Gene, die die Agrobakterien in Pflanzenzellen einschleusen können. Im Labor wird diese Plasmid-DNA verändert. Die tumorauslösenden Gene werden entfernt und meist zwei neue Gene werden eingefügt (dargestellt in rot). Erstens ein Gen, das der Pflanze eine neue Eigenschaft verleihen soll und zweitens ein sogenanntes Markergen, das den Zellen einen Selektionsvorteil beschert, auf dessen Wirkung wir später noch zurückkommen werden.
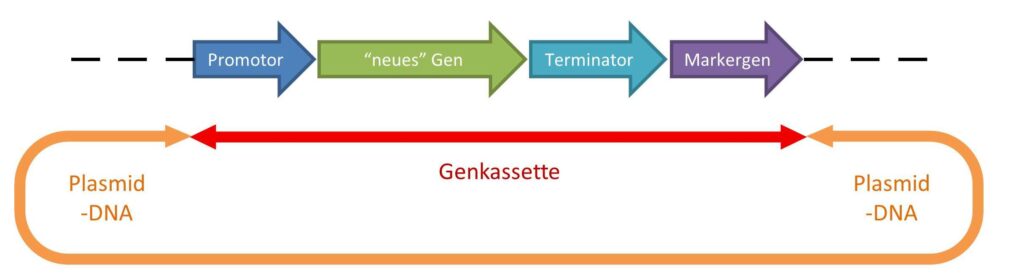
Ein so verändertes Plasmid hat einen typischen Aufbau, der in der unteren Abbildung noch einmal detaillierter zu sehen ist. Das veränderte Plasmid besitzt die erwähnten neuen Gene, die in einer sogenannten Genkassette zusammengefasst sind. Die Genkassette besteht aus mehreren Elementen, wie einer Startsequenz (Promotor = Genanschalter), dem gewünschten Gen, einer Endsequenz (Terminator = Stoppsignal) und häufig einem weiteren sogenannten Markergen. Das gewünschte Gen kann hierbei z.B. aus anderen Pflanzen stammen, während die Start- und Stopp-Sequenzen häufig aus Bakterien oder Viren übernommen werden. Der 35S-Promotor ist z.B. solch ein viraler Start, der in fast allen Pflanzen aktiv wirken kann und das jeweils neu eingeführte Gen konstant eingeschaltet hält.
Der Aufbau einer solchen Genkassette ist sehr einheitlich und dies kann man nutzen, um gentechnische Veränderungen nachzuweisen. Wie solche Nachweisverfahren durchgeführt werden, erfährst du hier.
Um Pflanzen gentechnisch zu verändern kann man zum Beispiel die Gewebekultur benutzen. Zuerst taucht man Blattstücke in eine Agrobakterien-Lösung und gibt den Bakterienzellen somit die Chance, ihre Plasmide in die Pflanzenzellen einzuschleusen. Anschließend legt man die Blattstücke auf einen Nährboden (Agar), der mit einer optimalen Mischung von Zuckern, Nährstoffen und Phytohormonen ausgestattet ist, damit die Zellen sich teilen können.
Wenn die fremde DNA erfolgreich in die Kern-DNA der Pflanzenzelle eingebaut wird und sich somit stabil im Genom befindet, spricht man von einer transformatierten Pflanzenzelle. So eine Transformation klappt aber nur bei sehr wenigen Zellen, etwa bei einer von hundert. Um eine gentechnisch veränderte Pflanze zu erzeugen, braucht man also nur die erfolgreich transformierten Pflanzenzellen. Nur diese sollen sich teilen und eine neue Pflanze bilden, die unveränderten Zellen werden nicht benötigt. Aber wie kann man nun transformierte von unveränderten Zellen unterscheiden? An dieser Stelle kommt wieder das Markergen ins Spiel. Das verschafft den transformierten Zellen einen Vorteil bei der Selektion.
Es gibt unterschiedliche Markergene, die im Labor zum Einsatz kommen. Weit verbreitet ist zum Beispiel die Methode, in die Pflanzenzellen ein Gen für Antibiotikaresistenz (AB-Resistenz) einzubringen. Auf antibiotikahaltigem Agar könnten sich dann nur die erfolgreich transformierten Zellen teilen, die anderen sterben ab.
Weitere Markergene mit entsprechender Selektionsmethode:
- Resistenz gegen ein Pflanzenvernichtungsmittel und anschließendes Besprühen der Blattstücke mit dem Herbizid
- Gen für die Verwendung eines seltenen Zuckers als Nährstoffquelle, nur dieser eine Zucker wird dann dem Agar zugesetzt
Viele Menschen haben die Befürchtung, dass sich die Antibiotikaresistenz-vermittelnden Markergene von Pflanzen auf Bakterien übertragen könnten und somit resistente Bakterienstämme entstünden. Die am häufigsten vermittelte AB-Resistenz richtet sich gegen das Antibiotikum Kanamycin. Viele der im Ackerboden befindlichen Bakterien haben aber bereits natürlicherweise eine Kanamycin-Resistenz und ein horizontaler Gentransfer zwischen Bakterien untereinander ist sehr viel wahrscheinlicher als ein Transfer von pflanzlichem Erbmaterial auf Bakterien. Trotzdem versucht man inzwischen ohne Antibiotikaresistenz-Marker auszukommen oder die Markergene nach erfolgreicher Selektion der gewünschten Zellen wieder aus dem Genom herauszuschneiden.
Weitere Informationen dazu findet man auch auf den Webseiten der bioSicherheit. In unserer Animation veranschaulichen wir auch noch einmal im Detail, wie der Prozess der Transformation mittels Agrobakterien abläuft:
Transformation – Das ist die Integration neuer Gene stabil in die DNA von Pflanzen. Das bedeutet, dass die Pflanzenzellen diese neue DNA als Teil ihrer eigenen betrachten, ablesen und die entsprechenden Proteine herstellen. Aber wie funktioniert das überhaupt? Um ein neues Gen in Pflanzen einzuschleusen, benutzen Forscher oft das Bodenbakterium Agrobacterium tumefaciens.
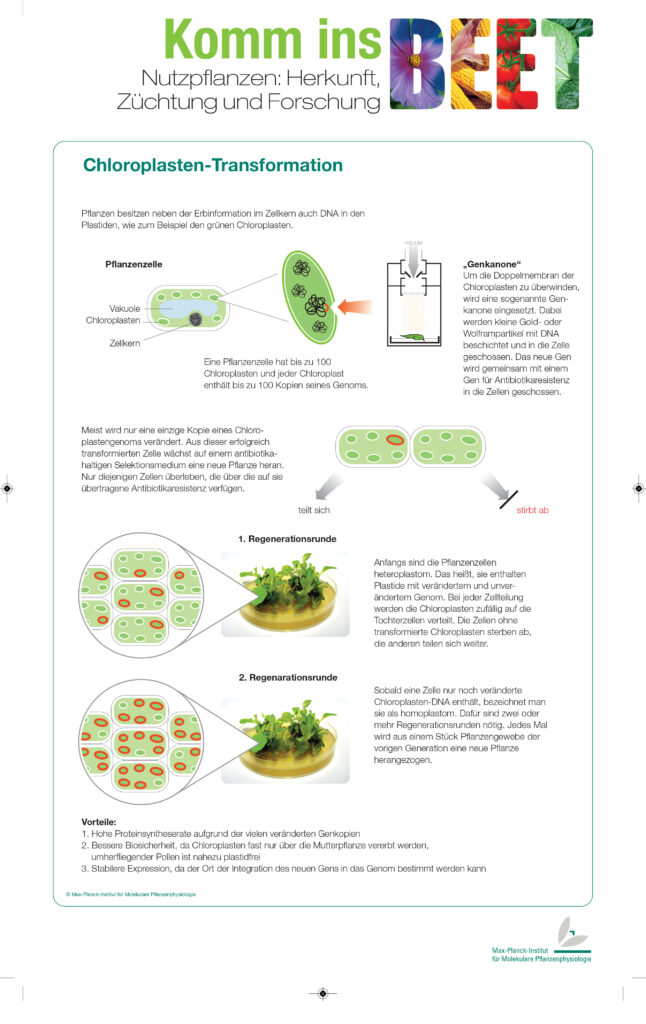
Plastidentransformation
Plastiden sind kleine Zellorganellen, die nur in Algen und Pflanzenzellen vorkommen. Die bekanntesten Vertreter sind die Chloroplasten, die den Pflanzen ihre grüne Farbe verleihen. Die Plastiden besitzen ein eigenes Genom, das sogenannte Plastom, das aus einer ringförmigen DNA besteht. Anders als das Kerngenom der meist diploiden Pflanzenzellen, das nur in doppelter Ausführung vorliegt, kann man in einer einzigen Blattzelle bis zu 10.000 Kopien des Plastoms finden. Das liegt daran, dass eine Zelle mehr als einhundert Plastiden besitzen kann und in einem Plastid dutzende Genkopien vorkommen können.[1]
Wenn man das Genom von Plastiden gentechnisch verändert um zum Beispiel die Pflanze zur Produktion eines neuen Proteins anzuregen, hat das gegenüber der Veränderung des Kerngenoms gleich mehrere Vorteile. Da Plastide vermutlich aus Prokaryoten, also Lebewesen ohne echten Zellkern hervorgegangen sind (Endosymbiontentheorie) lassen sich viele der Vorteile mit den Eigenschaften prokaryotischer DNA begründen:
1. Hohe Proteinsyntheserate dank zahlreicher Genkopien
Erstens erreicht man eine viel höhere Syntheserate des gewünschten Proteins, was auf die extrem hohe Anzahl an Genkopien zurückzuführen ist. Teilweise können bis zu 80 Prozent der gesamten von der Pflanze produzierten Proteinmenge auf das neue Gen zurückgeführt werden. Diese extrem hohe Syntheserate macht plastidentransformierte Pflanzen besonders attraktiv für die Produktion von Pharmazeutika.
2. Die Ausbreitung der neuen Gene in die Umwelt wird verringert
Plastide werden fast nur über mütterliche Keimzellen an die Nachkommen weitergegeben. Der umherfliegende Pollen enthält nur selten Plastide und somit besteht keine große Gefahr mehr, dass gentechnisch veränderte Pflanzen ihre neuen Eigenschaften in Wildarten auskreuzen.
3. Gene können an genau definierten Orten in das Genom eingebaut werden – ihre Expression ist stabiler
Wenn neue Gene in das Kerngenom integriert werden, geschieht das an einer unvorhersehbaren Stelle. Dabei kann es vorkommen, dass das neue Gen andere Pflanzengene in ihrer Funktion beeinträchtigt. Bei Chloroplasten-DNA hingegen wissen die Forscher ganz genau, wo das neue Gen in die Erbinformation eingefügt werden wird. Das liegt daran, dass die Integration der Fremd-DNA über sogenannte homologe Rekombination erfolgt. Dabei muss die Basenreihenfolge an den beiden Enden des einzufügenden Gens identisch mit einer Basenreihenfolge in der Chloroplasten-DNA sein. Genau an dieser Stelle wird dann das neue Gen in die ringförmige DNA eingefügt.
Im Zellkern kommt es manchmal auch vor, dass durch das Anfügen kleiner Moleküle Gene inaktiviert werden. Das kann auch bei neueingefügten Genen passieren, wodurch diese nicht mehr abgelesen werden würden. Dieser Vorgang heißt „epigenetische Genstilllegung“ und kommt im Plastiden-Genom nicht vor.
4. Gleichzeitige Expression mehrerer Gene
Will man mehrere neue Gene in eine Pflanze einschleusen, so hat Chloroplastentransformation einen weiteren Vorteil zu bieten. In Chloroplasten können mehrere Gene hintereinander als eine Einheit (Operon) abgelesen und somit auch als Einheit in das Pflanzengenom eingebracht werden. Das erleichtert die Arbeit der Forscher enorm.
5. Markergene lassen sich leichter entfernen
Die häufig verwendeten Antibiotika-Resistenzgene lassen sich aus prokaryotischer DNA leichter wieder entfernen.
Warum ist die Plastidentransformation nicht weiter verbreitet?
Die Transformation von Plastiden ist viel schwieriger als die Transformation des Kerngenoms. Die Chloroplasten sind von einer zusätzlichen Doppelmembran umgeben, die eine starke physikalische Barriere darstellt, durch die das neue Gen hindurchgeschleust werden muss. Eine Transformation mit Agrobakterien kommt demzufolge nicht in Frage. Erst durch die Erfindung der Genkanone wurde eine Plastidentransformation überhaupt möglich.
Eine weitere Schwierigkeit ist die Herstellung homoplastomer Pflanzen, also solcher, bei denen alle Plastiden das Transgen enthalten. Bei einer typischen Plastidentransformation erhält nur ein einziges Plasmid eines Chloroplasten einer Zelle das neue Gen. Fügt man dem Wachstumsmedium ein Antibiotikum hinzu, so liefert dieses Plasmid einen Selektionsvorteil, da es neben dem Zielgen auch ein Gen für die entsprechende Antibiotikaresistenz enthält. Bei jeder Zellteilung werden die Chloroplasten auf die Tochterzellen verteilt. Zellen, die dann keine transformierten Chloroplasten enthalten, sterben ab. Die anderen Zellen teilen sich weiter.
Wenn aus einer einzelnen Zelle in der Gewebekultur ein kleines Pflänzchen herangewachsen ist, nimmt man daraus wieder ein Blattstück und kultiviert es erneut unter Antibiotikaselektionsdruck. Diese Regenerationsrunden werden mehrmals wiederholt bis die Zelle und die daraus entstehende Pflanze homoplastom sind.
Warum müssen Pflanzen homoplastom sein?
Wenn in einer Pflanze nur einige Plastiden das neue Gen enthalten, die Pflanze also heteroplastom ist, so geht das Transgen nach und nach bei Wachstum und Vermehrung der Pflanze verloren. Das liegt daran, dass die Plastide bei der Zellteilung zufällig auf die entstehenden Tochterzellen aufgeteilt werden und es somit passieren kann, dass einige Gewebe gar keine transgenen Plastide mehr enthalten.